1. Epoque de la thermistance : découverte des apnées et des hypopnées.
En 1965, Henri Gastaut, un neurologue et épileptologue marseillais, qui étudiait l’épilepsie nocturne découvrit fortuitement l’existence des apnées. Dans une publication en français, il rapportait une respiration périodique et cyclique chez certains patients. Comme il ne s’intéressait pas particulièrement à la respiration, il s’était contenté de la « mesurer » à l’aide d’une thermistance qui ne réagissait qu’aux variations de température à proximité des narines et de la bouche (1).
En 1976, dix ans plus tard, le Pr Christian Guilleminault, un médecin français, neuropsychiatre de formation, proposait une définition du syndrome des apnées hypopnées obstructives du sommeil (SAHOS) (2) en créant l’index des apnées hypopnées (IAH). Avec la thermistance, il n’était possible que d’identifier des pauses respiratoires (absence totale du signal pendant plusieurs secondes) et certaines hypopnées sévères (chute partielle du gradient de température). Toutefois, les cliniciens réalisèrent très tôt qu’il existait des syndromes cliniques identiques au Syndrome des Apnées Hypopnées Obstructives du Sommeil (SAHOS) (ronflement et somnolence par exemple) sans qu’il y ait la moindre détection d’apnées ou d’hypopnées identifiable sur le signal de thermistance.
Ce n’est pourtant qu’en 1993, près de 30 ans après la mise en évidence des apnées que fut publié un article concernant l’identification de Trouble Respiratoire Obstructif du Sommeil (TROS) « non apnéique non hypopnéique (non A-H)» par le Pr Christian Guilleminault et ce, en utilisant la mesure de l’effort respiratoire par l’intermédiaire d’une sonde œsophagienne. Ce TROS Non AH est alors nommé « Syndrome d’Augmentation des Résistances des Voies Aériennes Supérieures » (Upper Airway Resistance Syndrome) (3). Bien qu’invasive, cette technique devint alors la technique de référence pour le diagnostic de tous les TROS non apnéiques.
2. Epoque de la canule nasale : découverte de l’événement de limitation de débit
En 1997, l’opportunité s’offrit à moi de rejoindre une équipe à New York qui travaillait sur les problématiques diagnostiques des TROS. C’est au cours de ce postdoc que nous avons validé la technique de la canule nasale qui permettait de mesurer un débit nasal au cours des études du sommeil (1-7). C’est à l’aide de cette technique, que nous découvrîmes un nouvel événement respiratoire : l’événement de limitation de débit (Flow limitation event) (Hosselet et al 1998).

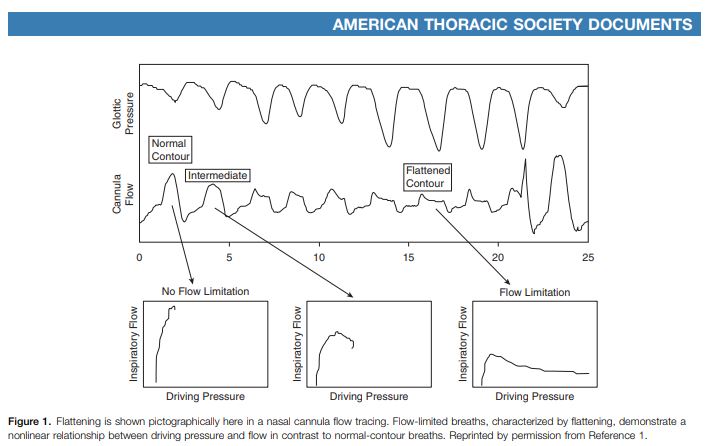
Nous démontrions ainsi que cette technique permettait désormais le diagnostic de tout le spectre des TROS sans recours à la mesure de la pression œsophagienne. Nous proposions alors une nouvelle classification des Troubles Respiratoires Obstructifs du Sommeil » (Hosselet et al. 2001). Nous insistions déjà sur l’importance de respecter certains éléments techniques afin d’obtenir un signal de bonne qualité permettant de bien identifier les évènements de limitation de débit.
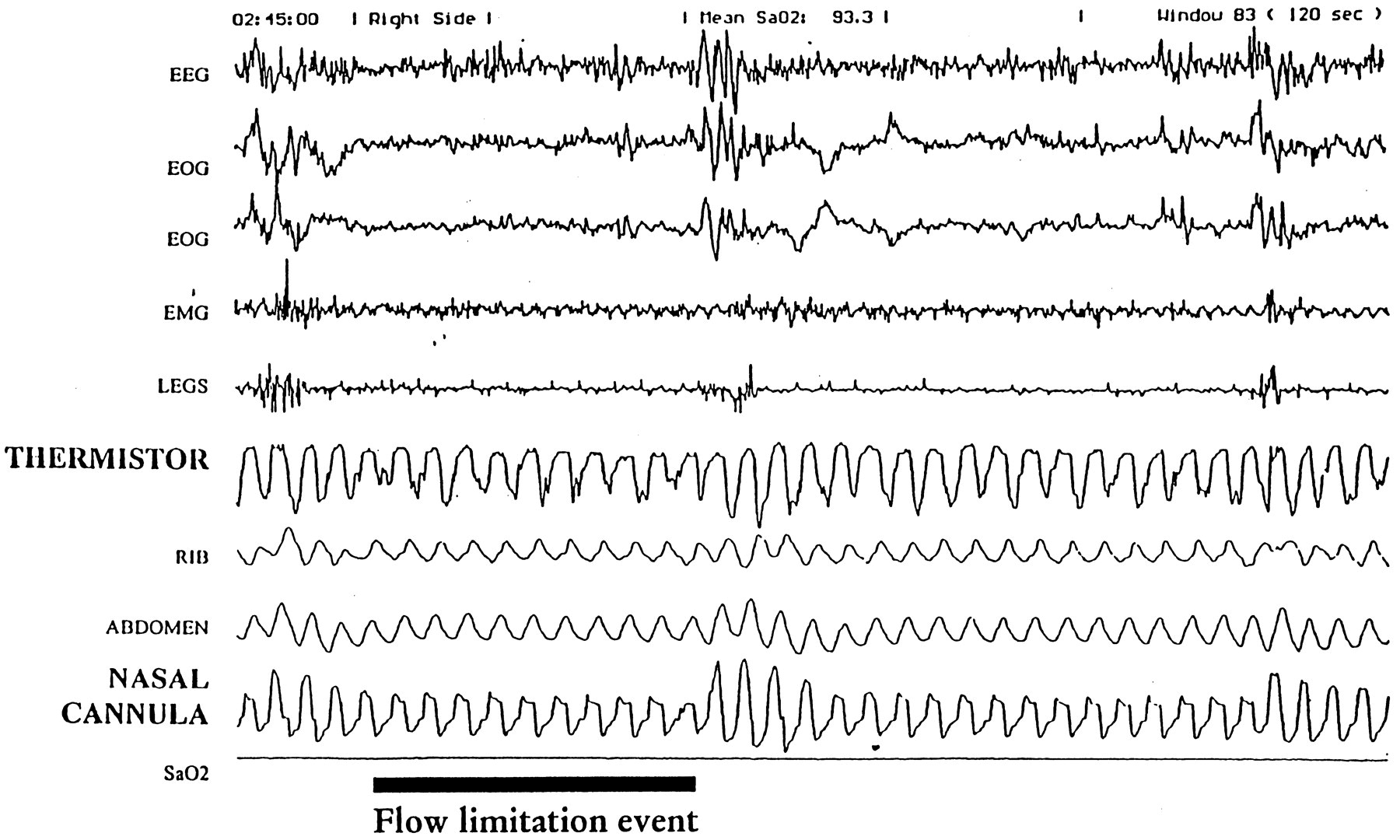
Des microéveils sont visibles sur l’EEG
Aucun événement n’est visible sur le signal de la thermistance
Sur le signal de la canule nasale, il est possible d’identifier des événements respiratoires que nous avons appelé « événement de limitation de débit »
En 2000, Indu Ayappa de la même équipe new-yorkaise démontrât que les événements de limitation de débit étaient strictement identiques aux événements d’augmentation de la pression œsophagienne (RERAS pour « Respiratory Event Related Arousals » ).
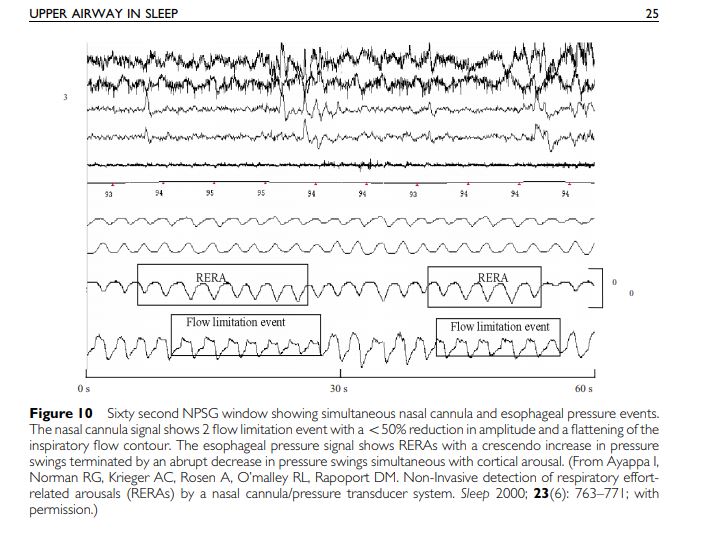
aui
signal de l’effort respiratoire ; augmentation de l’amplitude
qui correspond exactement aux évènements des limitation de débit (aplatissement du sommet du signal inspiratoire
la fin d’un évènement se caractérise par la minimisation de l’effort respiratoire et la normalisation du débit respiratoire (aspect arrondi du signal inspiratoire)
En 2002, l’utilisation de la canule nasale fût également validée chez le nourrisson. Cette technique devint aussi la référence chez l’enfant (Hang et al). Serebrisky et al confirmèrent la présence d’évènements de limitation de débit chez l’enfant que nous avions identifiés. Par la suite, notre technique fut confirmée par de nombreuses équipes à travers le monde. Elle devint la référence chez l’adulte et chez l’enfant.
Si les principaux constructeurs d’appareillage de Pression Positive continue (CPAP) ont intégré rapidement la limitation de débit ans leurs autoCPAP pour mieux détecteur les évènements respiratoires, les cliniciens ont tardé à la détecter afin de mieux diagnostiquer les TROS. On peut apporter quelques explications à cette situation. La première est relative aux recommandations de l’association américaine de la médecine du sommeil (American Association of Sleep Medicine). En effet, les premiers consensus pour le diagnostic des TROS furent un mélange des concepts de la canule nasale et de la thermistance. Ainsi, contrairement à nos propositions, l’AASM suggérait de garder la nécessité d’une diminution de débit de 50 puis de 30% et d’y associer une chute d’oxygène, les experts diminuèrent considérablement la sensibilité de notre méthodologie. De plus, certains constructeurs de polygraphes et de polysomnographes tardèrent à améliorer la sensibilité de la technique de mesure du débit selon nos spécifications. Ce qui explique, en partie, pourquoi un grand nombre de médecins ne cherchent toujours pas à identifier les événements de limitation de débit et continuent à ignorer des syndromes cliniques de TROS nonAH. Ce qui retarde considérablement le développement de la médecine du sommeil de l’enfant. Paradoxalement, il existe maintenant des logiciels qui peuvent détecter les événements de limitations de débit alors même qu’ils ne sont pas comptabilisés par les scoreurs. Conséquemment, malgré les faits scientifiques et cliniques, nombreux sont les cliniciens qui continuent à parler de « ronflement simple » ou « ronflement primaire » alors que ces jeunes patients souffrent d’authentiques Trouble Respiratoire Obstructif du Sommeil. En conséquence, il ne faut pas laisser un enfant ronfler chroniquement.
Le ronflement n’est que la partie bruyante d’un TROS qu’il soit détecté ou pas. Sa présence n’est d’ailleurs pas obligatoire en cas de TROS (notamment chez la femme ou la fille) mais sa présence est toujours pathologique. Il faut rappeler que pour ronfler nous devons augmenter l’effort respiratoire (notamment diaphragmatique) qui est mesurée par les augmentations de la pression œsophagienne. Dès lors qu’un patient augmente son effort alors qu’il est endormi, c’est que l’organisme détecte des anomalies respiratoires (le plus sensible est l’augmentation du gaz carbonique dans le sang). Et à partir de là, la qualité du sommeil est altérée : le sommeil est plus superficiel puisque toute tentative de l’approfondir aggraverait potentiellement les anomalies respiratoires. Puis le cerveau va générer des microéveils pour obtenir cycliquement des respirations normales. Par conséquent tout ronflement chronique est pathologique tant chez l’adulte que chez l’enfant et nécessite une prise en charge thérapeutique la plus précoce possible;
3. Situation actuelle : la pratique quotidienne de la médecine du sommeil semble bien en retard par rapport aux connaissances scientifiques accumulées ces 2 dernières décennies :
Plusieurs leaders d’opinions, ont déploré cette situation parce que, malheureusement, force est de constater que seule une minorité de cliniciens identifient la totalité des TROS de l’enfant et de l’adulte tant en milieu libéral qu’en milieu hospitalier et même en milieu hospitalo-universitaire (Arora &Guilleminault 2015, Krakow et al. 2014 et Pamidi 2017). Toutes ces publications rappellent l’impérieuse nécessité de comptabiliser les événements de limitations de débit parce que quotidiennement, de nombreux patients présentant tous les signes cliniques des TROS qui viennent consulter, se voient refuser la moindre prise en charge ou sont adressés en psychiatrie ou en pédopsychiatrie parce que leur index d’apnées hypopnées (IAH) n’atteint pas le chiffre des références ou qui est considéré à tort comme une référence. C’est pourquoi, le Pr Christian Guilleminault, regrettait publiquement d’avoir créer cet index « d’apnées d’hypopnées » qui fait plus de mal que de bien aux patients souffrant de TROS non apnéiques.
4.Bibliographie concernant la canule nasale et la limitation de débit
1 . Hosselet JJ, Norman RG, Ayappa I, Rapoport DM. Detection of flow limitation with a nasal cannula/pressure transducer system. Am J Respir Crit Care Med. 1998; 157:1461–1467
2. Ayappa I, Norman RG, Hosselet JJ, Gruenke RA, Walsleben JA, Rapoport DM. Relative occurrence of flow limitation and snoring during CPAP titration. Chest 1998; 114:685-90.
3. Hosselet JJ, Martinez JO, Gelb M, Binder D, Norman RG, Rapoport DM. Utility of identifying flow limitation in assessing the efficacy of oral appliance in mild sleep disordered breathing. Am J Respir Crit Care Med 1999; 159: A248
4. Hosselet JJ. Self-adjusted continuous airway positive and treatment of obstructive respiratory sleep disorders. Rev Mal Respir 1999; 16: 799-808.
5. Hosselet JJ, R G Norman, I Ayappa, JA Walsleben, DM Rapoport. Classification of sleep disordered breathing. Am J Respir Crit Care Med 2001; 163:398-405.
6. Hosselet JJ et al. Sleep disordered breathing in women with pre-eclampsia. Am J Respir Crit Care Med 2000: 162: A252(15)
7. Hosselet JJ, S Le Tuault, F Audibert, A Marfaing-Koka, et al. Detection of Non-Apneic Relation between sleep disordered breathing and endothelial dysfunction in women with pre-eclampsia. Am J Respir Crit Care Med 2001; 163: A34(16)
8. Hosselet JJ, Phaliah L., Joachim G., Offrer Y., Bearez G. Evaluation of maxillary expansion for the treatment of sleep disordered breathing in children. Am J Respir Crit Care Med 2009; 179: A1748(17)
9. Guilleminault C, Do Kim Y, Chowdhuri S, Horita M, Ohayon M, Kushida C. Sleep and daytime sleepiness in upper airway resistance syndrome compared to obstructive sleep apnoea syndrome. Eur Respir J. 2001;17:838–847
10. Meurice JC, Paquereau J, Denjean A, Patte F, Series F. Influence of correction of flow limitation on continuous positive airway pressure efficiency in sleep apnoea/hypopnoea syndrome. Eur Respir J. 1998; 11:1121–1127.
11. Berry RB, Budhiraja R, Gottlieb DJ, Gozal D, Iber C, Kapur VK, Marcus CL, Mehra R, Parthasarathy S, Quan SF, et al. American Academy of Sleep Medicine; Deliberations of the Sleep Apnea Definitions Task Force of the American Academy of Sleep Medicine. Rules for scoring respiratory events in sleep: update of the 2007 AASM Manual for the Scoring of Sleep and Associated Events. J Clin Sleep Med. 2012;8:597–619.
12. Pépin JL, Guillot M, Tamisier R, Lévy P. The upper airway resistance syndrome. Respiration. 2012;83:559–566.
13. Montserrat JM, Farré R, Ballester E, Felez MA, Pastó M, Navajas D. Evaluation of nasal prongs for estimating nasal flow. Am J Respir Crit Care Med. 1997;155:211–215
14. Brigham and Women’s Hospital, Harvard University. National Sleep Research Resource. 2017 [updated 2017; accessed 2015 Oct 13]. Available from: https://sleepdata.org.
15. Condos R, Norman RG, Krishnasamy I, Peduzzi N, Goldring RM, Rapoport DM. Flow limitation as a noninvasive assessment of residual upper-airway resistance during continuous positive airway pressure therapy of obstructive sleep apnea. Am J Respir Crit Care Med. 1994;150:475–480
16. Ayappa I, Norman RG, Krieger AC, Rosen A, O’malley RL, Rapoport DM. Non-invasive detection of respiratory effort–related arousals (RERAs) by a nasal cannula/pressure transducer system. Sleep. 2000;23:763–771;
17. Heitman SJ, Atkar RS, Hajduk EA, Wanner RA, Flemons WW. Validation of nasal pressure for the identification of apneas/hypopneas during sleep. Am J Respir Crit Care Med. 2002;166:386–391
18. Farré R, Rigau J, Montserrat JM, Ballester E, Navajas D. Relevance of linearizing nasal prongs for assessing hypopneas and flow limitation during sleep. Am J Respir Crit Care Med. 2001;163:494–497.
19.. Clark SA, Wilson CR, Satoh M, Pegelow D, Dempsey JA. Assessment of inspiratory flow limitation invasively and noninvasively during sleep. Am J Respir Crit Care Med. 1998;158:713–722.
20. Hudgel DW, Hendricks C, Hamilton HB. Characteristics of the upper airway pressure-flow relationship during sleep. J Appl Physiol (1985) 1988;64:1930–1935.
14 . Mansour KF, Rowley JA, Meshenish AA, Shkoukani MA, Badr MS. A mathematical model to detect inspiratory flow limitation during sleep. J Appl Physiol (1985) 2002;93:1084–1092.
21 . Morgenstern C, Jane R, Schwaibold M, Randerath W. Characterization of inspiratory flow limitation during sleep with an exponential model. Conf Proc IEEE Eng Med Biol Soc. 2008;2008:2439–2442.
22 . Owens RL, Edwards BA, Sands SA, Butler JP, Eckert DJ, White DP, Malhotra A, Wellman A. The classical Starling resistor model often does not predict inspiratory airflow patterns in the human upper airway. J Appl Physiol (1985) 2014;116:1105–1112
23 . Schneider H, Krishnan V, Pichard LE, Patil SP, Smith PL, Schwartz AR. Inspiratory duty cycle responses to flow limitation predict nocturnal hypoventilation. Eur Respir J. 2009;33:1068–1076.
24 . Bloch KE, Russi EW, Kaplan V. Variability of inspiratory conductance quantifies flow limitation. Clin Sci (Lond) 2004;106:589–598.
25 . Tamisier R, Pepin JL, Wuyam B, Smith R, Argod J, Levy P. Characterization of pharyngeal resistance during sleep in a spectrum of sleep-disordered breathing. J Appl Physiol (1985) 2000;89:120–130.
26 . Schwartz AR, Smith PL, Wise RA, Gold AR, Permutt S. Induction of upper airway occlusion in sleeping individuals with subatmospheric nasal pressure. J Appl Physiol (1985) 1988;64:535–542.
27 . Smith PL, Wise RA, Gold AR, Schwartz AR, Permutt S. Upper airway pressure-flow relationships in obstructive sleep apnea. J Appl Physiol (1985) 1988;64:789–795.
28 . Owens RL, Edwards BA, Sands SA, Butler JP, Eckert DJ, White DP, Malhotra A, Wellman A. Upper airway collapsibility and patterns of flow limitation at constant end-expiratory lung volume. J Appl Physiol (1985) 2012;113:691–699.
29 . Wellman A, Genta PR, Owens RL, Edwards BA, Sands SA, Loring SH, White DP, Jackson AC, Pedersen OF, Butler JP. Test of the Starling resistor model in the human upper airway during sleep. J Appl Physiol (1985) 2014;117:1478–1485.
30 . Mooney AM, Abounasr KK, Rapoport DM, Ayappa I. Relative prolongation of inspiratory time predicts high versus low resistance categorization of hypopneas. J Clin Sleep Med. 2012;8:177–185.
31 . Stoohs R, Guilleminault C. Snoring during NREM sleep: respiratory timing, esophageal pressure and EEG arousal. Respir Physiol. 1991;85:151–167.
32 . Skatrud JB, Dempsey JA. Airway resistance and respiratory muscle function in snorers during NREM sleep. J Appl Physiol (1985) 1985;59:328–335.
33 . Issa FG, Sullivan CE. Upper airway closing pressures in obstructive sleep apnea. J Appl Physiol. 1984;57:520–527.
34 . Cirignotta F, Lugaresi E. Some cineradiographic aspects of snoring and obstructive apneas. Sleep. 1980;3:225–226.
35 . Stoohs R, Skrobal A, Guilleminault C. Does snoring intensity predict flow limitation or respiratory effort during sleep? Respir Physiol. 1993;92:27–38.
36 . Montserrat JM, Ballester E, Olivi H, Reolid A, Lloberes P, Morello A, Rodriguez-Roisin R. Time-course of stepwise CPAP titration: behavior of respiratory and neurological variables. Am J Respir Crit Care Med. 1995;152:1854–1859.
37 . Teschler H, Berthon-Jones M, Thompson AB, Henkel A, Henry J, Konietzko N. Automated continuous positive airway pressure titration for obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 1996;154:734–740.
38 . Norman RG, Rapoport DM, Ayappa I. Detection of flow limitation in obstructive sleep apnea with an artificial neural network. Physiol Meas. 2007;28:1089–1100.
39 . Aittokallio T, Saaresranta T, Polo-Kantola P, Nevalainen O, Polo O. Analysis of inspiratory flow shapes in patients with partial upper-airway obstruction during sleep. Chest. 2001;119:37–44.
40. Morgenstern C, Jane R, Schwaibold M, Randerath W. Automatic classification of inspiratory flow limitation assessed non-invasively during sleep. Conf Proc IEEE Eng Med Biol Soc. 2008;2008:1132–1135.
41 . Morgenstern C, Schwaibold M, Randerath W, Bolz A, Jane R. Automatic non-invasive differentiation of obstructive and central hypopneas with nasal airflow compared to esophageal pressure. Conf Proc IEEE Eng Med Biol Soc. 2010;2010:6142–6145.
42 . Morgenstern C, Schwaibold M, Randerath WJ, Bolz A, Jané R. Assessment of changes in upper airway obstruction by automatic identification of inspiratory flow limitation during sleep. IEEE Trans Biomed Eng. 2009;56:2006–2015.
43 . Bijaoui EL, Champagne V, Baconnier PF, Kimoff RJ, Bates JH. Mechanical properties of the lung and upper airways in patients with sleep-disordered breathing. Am J Respir Crit Care Med. 2002;165:1055–1061.
44 . Lorino AM, Lofaso F, Abi-Nader F, Drogou I, Dahan E, Zerah F, Harf A, Lorino H. Nasal airflow resistance measurement: forced oscillation technique versus posterior rhinomanometry. Eur Respir J. 1998;11:720–725.
45 . Navajas D, Farré R, Rotger M, Badia R, Puig-de-Morales M, Montserrat JM. Assessment of airflow obstruction during CPAP by means of forced oscillation in patients with sleep apnea. Am J Respir Crit Care Med. 1998;157:1526–1530.
46 . Farré R, Peslin R, Rotger M, Navajas D. Inspiratory dynamic obstruction detected by forced oscillation during CPAP: a model study. Am J Respir Crit Care Med. 1997;155:952–956.
47 . Rauhala E, Himanen SL, Saastamoinen A, Polo O. Prolonged spiking in the Emfit sensor in patients with sleep-disordered breathing is characterized by increase in transcutaneous carbon dioxide. Physiol Meas. 2007;28:1163–1173.
48 . Rimpilä V, Hosokawa K, Huhtala H, Saaresranta T, Salminen AV, Polo O. Transcutaneous carbon dioxide during sleep-disordered breathing. Respir Physiol Neurobiol. 2015;219:95–102.
49 . Calero G, Farre R, Ballester E, Hernandez L, Daniel N, Montserrat Canal JM. Physiological consequences of prolonged periods of flow limitation in patients with sleep apnea hypopnea syndrome. Respir Med. 2006;100:813–817.
50 . Palombini LO, Tufik S, Rapoport DM, Ayappa IA, Guilleminault C, de Godoy LB, Castro LS, Bittencourt L. Inspiratory flow limitation in a normal population of adults in São Paulo, Brazil. Sleep. 2013;36:1663–1668.
51 . Stoohs RA, Knaack L, Blum HC, Janicki J, Hohenhorst W. Differences in clinical features of upper airway resistance syndrome, primary snoring, and obstructive sleep apnea/hypopnea syndrome. Sleep Med. 2008;9:121–128.
52 . Broderick JE, Gold MS, Amin MM, Gold AR. The association of somatic arousal with the symptoms of upper airway resistance syndrome. Sleep Med. 2014;15:436–443.
53 . Kristo DA, Lettieri CJ, Andrada T, Taylor Y, Eliasson AH. Silent upper airway resistance syndrome: prevalence in a mixed military population. Chest. 2005;127:1654–1657.
54 . Pelin Z, Karadeniz D, Oztürk L, Gözükirmizi E, Kaynak H. The role of mean inspiratory effort on daytime sleepiness. Eur Respir J. 2003;21:688–694.
55 . Guilleminault C, Kirisoglu C, Poyares D, Palombini L, Leger D, Farid-Moayer M, Ohayon MM. Upper airway resistance syndrome: a long-term outcome study. J Psychiatr Res. 2006;40:273–279
56 . Jullian-Desayes I, Tamisier R, Zarski JP, Aron-Wisnewsky J, Launois-Rollinat SH, Trocme C, Levy P, Joyeux-Faure M, Pepin JL. Impact of effective versus sham continuous positive airway pressure on liver injury in obstructive sleep apnoea: data from randomized trials. Respirology. 2016;21:378–385.
57 . Pamidi S, Pinto LM, Marc I, Benedetti A, Schwartzman K, Kimoff RJ. Maternal sleep-disordered breathing and adverse pregnancy outcomes: a systematic review and metaanalysis. Am J Obstet Gynecol. 2014;210:52.e1–52.e14. ]
58 . Bourjeily G, Fung JY, Sharkey KM, Walia P, Kao M, Moore R, Martin S, Raker CA, Millman RP. Airflow limitations in pregnant women suspected of sleep-disordered breathing. Sleep Med. 2014;15:550–555.
59 . Connolly G, Razak AR, Hayanga A, Russell A, McKenna P, McNicholas WT. Inspiratory flow limitation during sleep in pre-eclampsia: comparison with normal pregnant and nonpregnant women. Eur Respir J. 2001;18:672–676.
60 . Edwards N, Blyton DM, Kirjavainen T, Kesby GJ, Sullivan CE. Nasal continuous positive airway pressure reduces sleep-induced blood pressure increments in preeclampsia. Am J Respir Crit Care Med. 2000;162:252–257.
61 . McGinley B, Halbower A, Schwartz AR, Smith PL, Patil SP, Schneider H. Effect of a high-flow open nasal cannula system on obstructive sleep apnea in children. Pediatrics. 2009;124:179–188.
62 . O’Brien LM, Tauman R, Gozal D. Sleep pressure correlates of cognitive and behavioral morbidity in snoring children. Sleep. 2004;27:279–282. 6 . Kennedy JD, Blunden S, Hirte C, Parsons DW, Martin AJ, Crowe E, Williams D, Pamula Y, Lushington K. Reduced neurocognition in children who snore. Pediatr Pulmonol. 2004;37:330–337.
